Músculo Esquelético
La fibra muscular esquelética es la más grande, con diámetros de cerca de 5 a 100 um de diámetro y algunos cm de largo (en realidad las células musculares han unido sus membranas celulares o sarcolemas, conformando un pseudo sincicio).
Las estriaciones de los músculos esquelético (y cardíaco) se deben a su constitución por sarcómeros (pequeñas unidades de músculo, en una traducción literal). Esta estructura tiene en reposo 25.000 Å de largo en el músculo esquelético.
Los límites del sarcómero se denominan líneas Z y distan 25.000 Å una de otra. Viene luego de una línea Z, una banda I de 4.500 Å de largo y en la porción central una banda A de 16.000 iotra banda I y luego la línea Z. Hacia la mitad de la banda A aparece un espacio menos denso, la zona H (Figura 9).
En la banda I hay un sistema de filamentos que corren en paralelo, constituidos por las proteínas actina, tropomiosina y troponinas (que son tres: tipos I, T y C). Estos son llamados filamentos delgados (Figura 10).
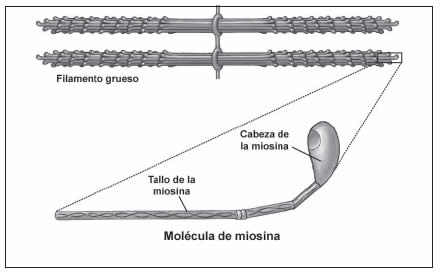
En la banda A hay filamentos delgados que cursan entre los filamentos gruesos. Los filamentos gruesos están constituidos por una proteína llamada miosina. Esta molécula posee dos gruesas proyecciones cortas (“cabezas” de miosina) que emergen a intervalos de los filamentos gruesos. La zona H sólo presenta filamentos gruesos y no filamentos delgados (Figura 11).
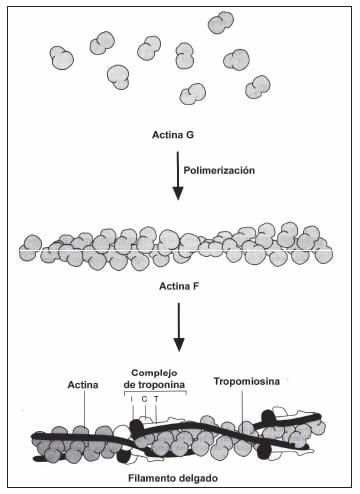
Las moléculas de actina del filamento delgado son globulares, y están unidas formando una especie de collar de perlas doble. La zona que queda hacia el interior del doble collar se llama hendidura. La actina puede unirse a las cabezas de miosina, y esta unión no tiene lugar en reposo porque los sitios de unión en la actina están “tapados” por la tropomiosina, que tiene una estructura fibrilar (Figura 12A). Cada molécula de tropomiosina puede tapar los sitios de unión de siete moléculas de actina. Cada siete monómeros de actina está dispuesto el trímero (tres unidades) de troponina. La subunidad T está unida a la tropomiosina, la subunidad I a la actina, y la subunidad C a ambas. En esta condición se dice que el filamento delgado está “off” (Figura 12B).
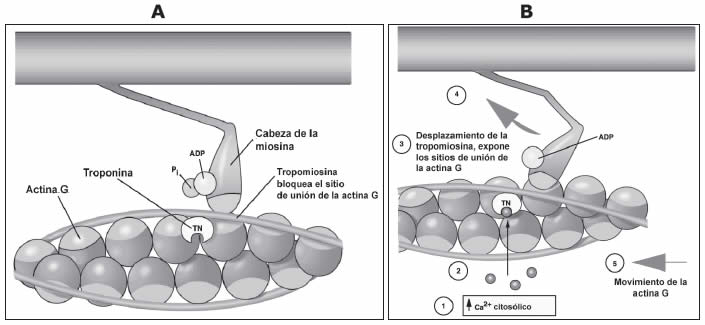
En condiciones de reposo la concentración del ion calcio en el citoplasma de la célula muscular (sarcoplasma) es muy baja. Sin embargo, en el interior del retículo sarcoplásmico (retículo endoplásmico muscular) el calcio se encuentra almacenado en alta concentración.
Bioquímica de la contracción muscular
La contracción muscular se origina por la unión y separación cíclica de la cabeza globular de la miosina al filamento de actina. La unión es seguida por un cambio en la interacción entre actina y miosina, de modo que los filamentos de actina (filamentos delgados) y miosina (filamentos gruesos) se deslizan uno sobre otro.