Agua
La vida apareció en el agua, y hasta ahora es uno de los requisitos esenciales para su existencia. Además, es importante señalar que la mayoría de las reacciones químicas ocurren en un entorno acuoso y la molécula de agua es el compuesto más abundante en los seres vivos ya que ocupa aproximadamente entre un 65% a un 95% de su masa. Este porcentaje varía dependiendo del metabolismo del organismo.
| Organismo | % |
|---|---|
| Algas | 98 |
| Caracol | 80 |
| Crustáceos | 77 |
| Espárragos | 93 |
| Espinacas | 93 |
| Estrella de mar | 76 |
| Persona adulta | 62 |
| Lechuga | 95 |
| Medusa | 95 |
| Semilla | 10 |
| Tabaco | 92 |
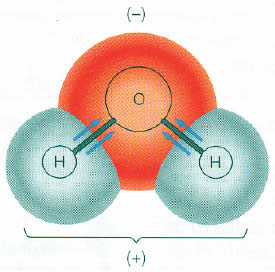
En la molécula de agua (H20) los dos átomos de hidrógeno están unidos al átomo de oxígeno por enlaces covalentes (Figura 1).
La molécula es fuertemente polar, porque el oxígeno atrae más a los electrones que los átomos de hidrógeno. Por ello, la molécula de agua actúa como un dipolo, ya que para cada enlace covalente hay una débil carga electronegativa alrededor del átomo de oxígeno, y una débil carga electropositiva alrededor de los átomos de hidrógeno.
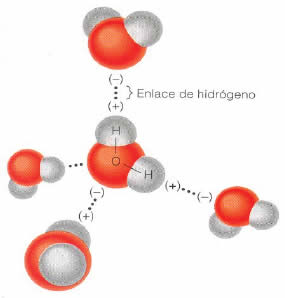
Así , las moléculas de agua pueden formar puentes de hidrógeno con ellas mismas (Figuras 2 y 3). Estos puentes son mucho más débiles que los enlaces covalentes, y además, son de corta duración. No obstante, dada la cantidad de ellos, sus efectos determinan la mayoría de las propiedades del agua (Tabla 2).
| Es líquida a temperatura ambiente. | Los puentes de hidrógeno mantienen a las moléculas unidas. Por eso, aunque por su peso molecular debería ser un gas, es un líquido. |
| Tiene alto calor de vaporización. | Para que el agua comience a evaporarse hay que suministrar energía calorífica suficiente para que las moléculas rompan sus puentes de hidrógeno y salgan del líquido. Los seres vivos utilizan esta propiedad para refrescarse al evaporarse el sudor. |
| Tiene elevada tensión superficial. | Las moléculas de la superficie están fuertemente unidas a otras del interior (la superficie es como una piel tensa, pero elástica, de la que cuesta separar moléculas). Algunos organismos, como pequeños y livianos insectos, se desplazan por la película superficial de agua. |
| Tiene elevado calor específico. | El agua puede absorber una gran cantidad de calor antes de elevar su temperatura, ya que lo emplea en romper los puentes de hidrógeno. Los seres vivos usan el agua como aislante térmico. |
| Es uno de los mejores disolventes que se conoce. | La mayoría de las sustancias polares son capaces de disolverse en el agua al formar puentes de hidrógeno en ella. |
| Tiene cohesión y adhesión | La cohesión se define como la unión entre las moléculas de agua y la adhesión es la unión a otras moléculas con cargas eléctricas netas o débiles. |
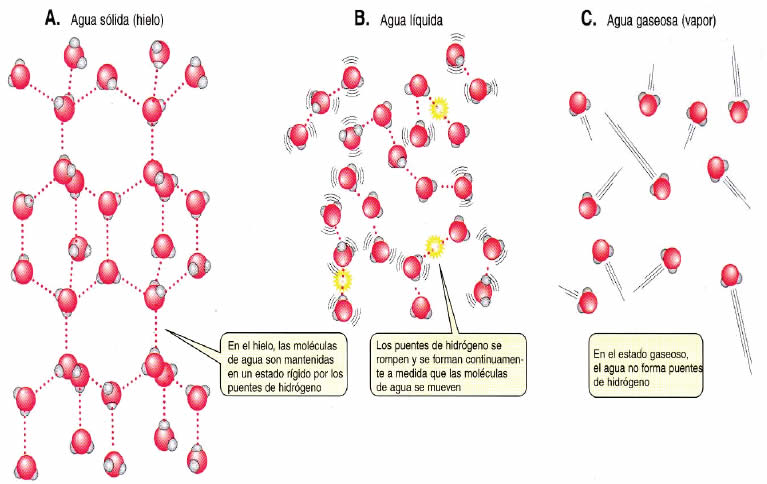
Gracias a la cohesión el agua experimenta capilaridad, es decir, movimiento por espacios muy pequeños con cargas eléctricas, y a la adsorción el poder penetrar en materiales sólidos porosos con cargas eléctricas, hinchándolos.Tiene mayor densidad en estado líquido que en el estado sólido.Los puentes de hidrógeno “congelados” mantienen las moléculas más separadas que en el estado líquido.
El hielo flota sobre el agua por eso, en climas fríos los lagos y mares se congelan en la superficie y el hielo actúa como aislante para las capas inferiores que permanecen líquidas.